El principal tratamiento es la resección quirúrgica del tumor, siendo el único tratamiento con intención curativa. Es importante aclarar que en caso de tumores menores o iguales a 2cm, únicos y asintomáticos, el tratamiento quirúrgico es controversial, pudiendo no ser indicado. Dichos casos, requieren un seguimiento estricto con la intención de pesquisar el posible crecimiento del tumor o aparición de síntomas asociados.
Aproximadamente el 80% de los pacientes al momento del diagnóstico tienen un tumor único localizado, siendo la situación ideal, la extracción del tumor primario único con márgenes limpios (sin células malignas). La cirugía laparoscópica permanece controversial, sin embargo, en ciertos casos, si la localización es favorable, puede ser una opción terapéutica.
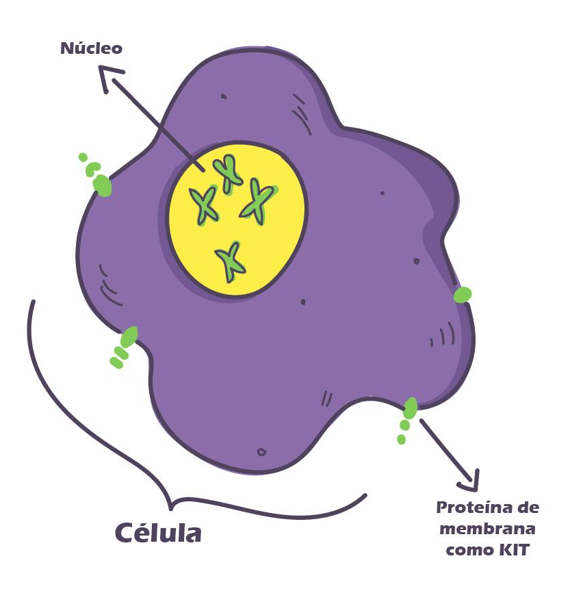
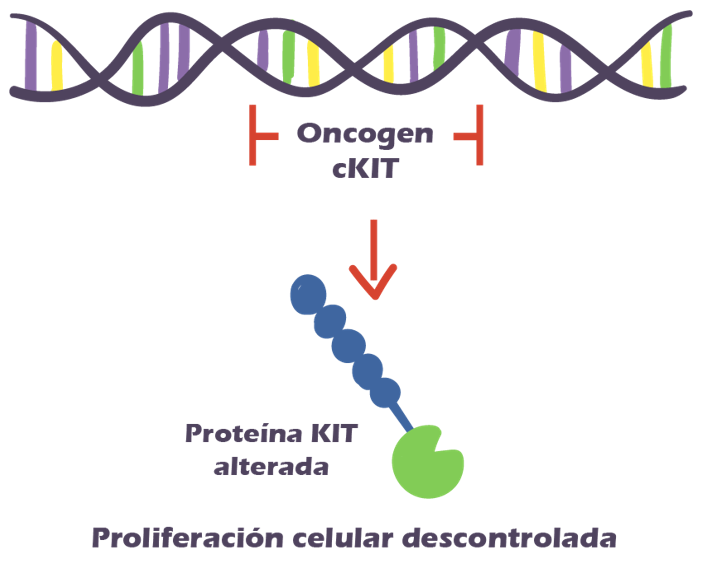
En cuanto a terapias adyuvantes (tratamientos adicionales post cirugía) y neoadyuvante (tratamiento adicional previo a la cirugía), como ya mencionamos anteriormente, existen medicamentos como el imatinib. Dicho tratamiento, consiste en un inhibidor selectivo de kinasa que se une a los receptores KIT activados y bloquea la vía de señalización celular, evitando la proliferación celular descontrolada en aquellos que tengan la mutación acorde. Imatinib tiene una tasa de respuesta aproximada del 76% .
El uso de imatinib previo a la cirugía ha mostrado ser útil en tumores difíciles de resecar, de gran tamaño, que invadan otros órganos, entre otros. De esta manera, su uso permite la disminución del tamaño del tumor, mejorando el pronóstico y reduciendo las complicaciones post cirugía. Su uso como neoadyuvante, no está indicado en pacientes con mutación PDGFRA, SDH, o GIST asociado a neurofibromatosis, en cuyos casos se pasa directamente a la cirugía.
El uso post cirugía de imatinib, ha mostrado principalmente una disminución en las recurrencias y, por lo tanto, un mejor pronóstico a largo plazo. Los casos en que está indicado son generalmente en aquellos que tengan un riesgo de recurrencia de un 30-50%; porcentaje calculado de acuerdo con el tamaño del tumor, el índice mitótico (cuántas células se encuentran en división en relación a las que no lo están), la localización y la presencia o ausencia de rotura del tumor (espontánea o durante la cirugía).
De acuerdo con los estudios, imatinib y otros semejantes, tendrían un papel importante en la disminución de la mortalidad. Es relevante mencionar la existencia de efectos adversos asociados a dicho medicamento, siendo los más frecuentes; fatiga, síntomas digestivos y la disminución de glóbulos blancos (mayor riesgo de infecciones), describiremos mayormente los síntomas adversos y que conducta debe ser tomada al final de esta sección.
Además del imatinib, existen otras terapias que pueden utilizarse de primera, segunda o tercera línea, dependiendo del tipo de mutación que tenga ese individuo en particular. Veremos este aspecto con más detalle en los tratamientos actuales.
A pesar de la diversidad de tratamientos, dada la naturaleza de la patología, y la presencia de resistencia de algunos subtipos de GIST a imatinib y sunitinib (mutación PDGFRA D842V) y de resistencia al tratamiento a largo plazo, existen en constante desarrollo diversos estudios en que se investigan otras alternativas terapéuticas como son el ponatinib, nivolumab, entre otros.
Tabla de resistencias a diferentes tratamientos según tipo de mutación.
Para pacientes con metástasis hepática, además de la posibilidad de extracción quirúrgica de la lesión en algunos casos, existen otros procedimientos de carácter local disponibles como son la embolización transarterial y la ablación por radiofrecuencia.
En cuanto a la quimioterapia y radioterapia, solamente mencionar que la primera no ha mostrado ser efectiva, y la segunda por su parte, no tiene utilidad alguna al tratarse de tumores resistentes a dicho tratamiento.
Como es de suponer de acuerdo con lo mencionado anteriormente, al igual como sucede con otros tipos de cáncer, el tratamiento será evaluado y efectuado por un equipo multidisciplinario.
¿Qué sucede hoy en día respecto a los nuevos tratamientos considerando los aspectos moleculares de GIST?
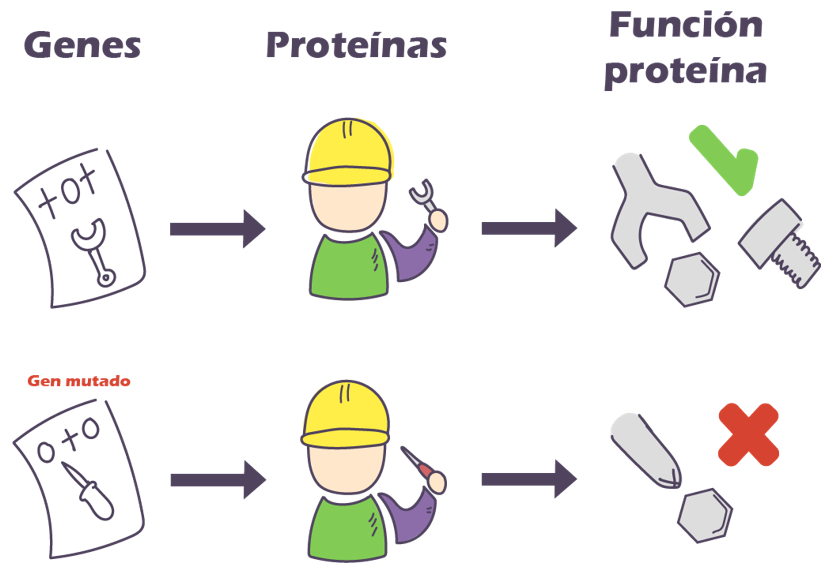
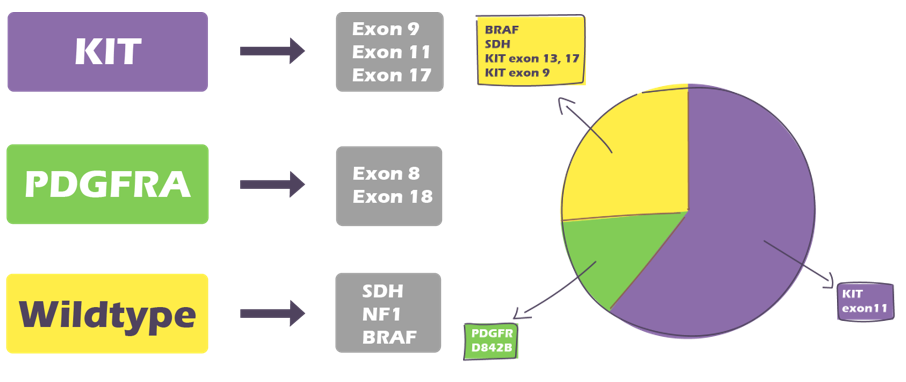
En la actualidad, nos hemos dado cuenta de que existen muchos tipos de GIST, diferenciados a nivel genético. La mayoría de los GIST tienen mutaciones a nivel de KIT como mencionamos anteriormente, pero alrededor de un 25% no tienen esta mutación, y expresan el wild-type, con una expresión normal de KIT.
Alrededor del 15% tienen una mutación en un gen relacionado, el PDGFRA. Algunos tienen mutaciones en otros genes como RAS, BRAF, NF1, NTRK o SDH, y probablemente algunos más que aún se desconocen.
Porcentajes respecto a cada tipo de mutación y localización:
Estas formas menos frecuentes de GIST son distintas a la forma con mutación de KIT en términos de su biología y tratamiento. Cabe mencionar, que todos estos tipos de GIST expresan la proteína KIT independiente a si el gen de KIT se encuentra mutado o no.
Medicamentos aprobados en la actualidad para el uso en GISTs
1. Gleevec - Imatinib
2. Sutent - Sunitinib
3. Stivarga - Regorafenib
4. Qinlock - Ripretinib
5. Ayvakit - Avapritinib
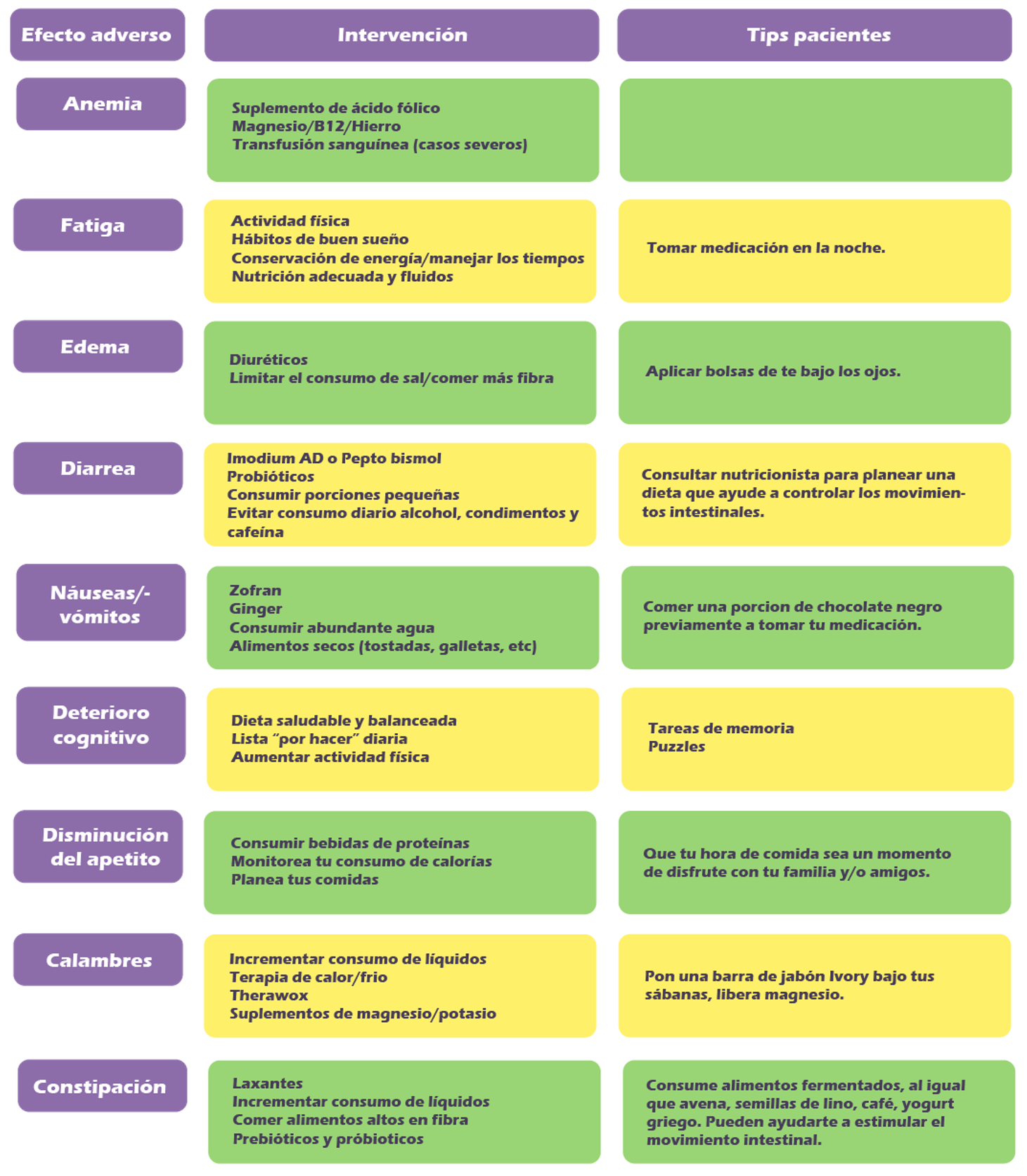
Efectos adversos en uso de medicamentos en GISTs
6. Gleevec - Imatinib: Fatiga, náuseas, diarrea, calambres, edema (acumulación de líquidos).
7. Sutent - Sunitinib: Diarrea, síndrome pie-mano, fatiga, úlceras en boca, hipertensión.
8. Stivarga - Regorafenib: Síndrome de pie-mano, fatiga, diarrea, calambres, hipertensión.
9. Qinlock - Ripretinib: Calambres, alopecia, fatiga, síndrome pie-mano, náuseas.
10. Ayvakit - Avapritinib: deterioro cognitivo, fatiga, edema (acumulación de líquidos), diarrea, náuseas.
Tabla de recomendaciones: